La tensión superficial y el pH de la solución, la temperatura ambiente y procesos como la oxidación, la fotolisis o la descomposición enzimática se deben tener en cuenta al utilizar fármacos solubles.
El camino que recorre un medicamento desde que se incorpora al agua y se solubiliza hasta que ejerce su acción en los animales es largo y esta sujeto a numerosas variables.
La solubilidad de un producto se define como la cantidad de soluto que puede disolverse en unas condiciones de temperatura y presión determinadas. En realidad, la disolución de un producto solido es una competición entre las fuerzas que mantienen unidas las moléculas del soluto y las del solvente.
Cuando hablamos de estabilidad en solución nos referimos al proceso de degradación que sufre el principio activo desde que se ha disuelto, y que conlleva cambios organolépticos, aparición de productos de degracion –que pueden llegar a ser toxicos o perjudiciales- y perdida de actividad. Todos los principios activos en disolución sufren procesos de degradación mas o menos acusados en función de diferentes factores (temperatura, pH, dureza del agua, etc.) y de la concentración del compuesto en el agua. Este hecho es especialmente importante en las soluciones madre de las bombas dosificadoras ya que, cuanto mayor sea la concentración, mayor será la velocidad de las reacciones químicas de degradación.
El agua, además de la importancia que tiene en si misma como nutriente, es especialmente relevante en medicación por constituir el solvente en el que disolveremos los medicamentos que queremos administrar a los animales. El agua es un solvente polar, es decir, aunque su carga total es neutra, presenta dos polos claramente diferenciados de carácter positivo (dos moléculas de hidrogeno) y negativo (una molecula de oxigeno). La regla básica de la solubilidad de productos es la siguiente: “igual disuelve a igual”, es decir, los compuestos polares y los apolares, en apolares.
Los productos solubles comercializados en veterinaria se encuentran habitualmente en forma de sales ionicas (con carácter polar). En estos casos, las moléculas de agua rodean los iones de la sal (el oxigeno rodeara los cationes y el hidrogeno, los aniones) rompiendo la red cristalina que la mantiene unida en un proceso que conlleva su disolución y se conoce como hidratación.
El objetivo de este articulo es revisar los principales factores que afectan a la solubilidad y a la estabilidad de las soluciones farmacológicas y ofrecer unas recomendaciones básicas para obtener en la practica la máxima eficacia de los productos utilizados.
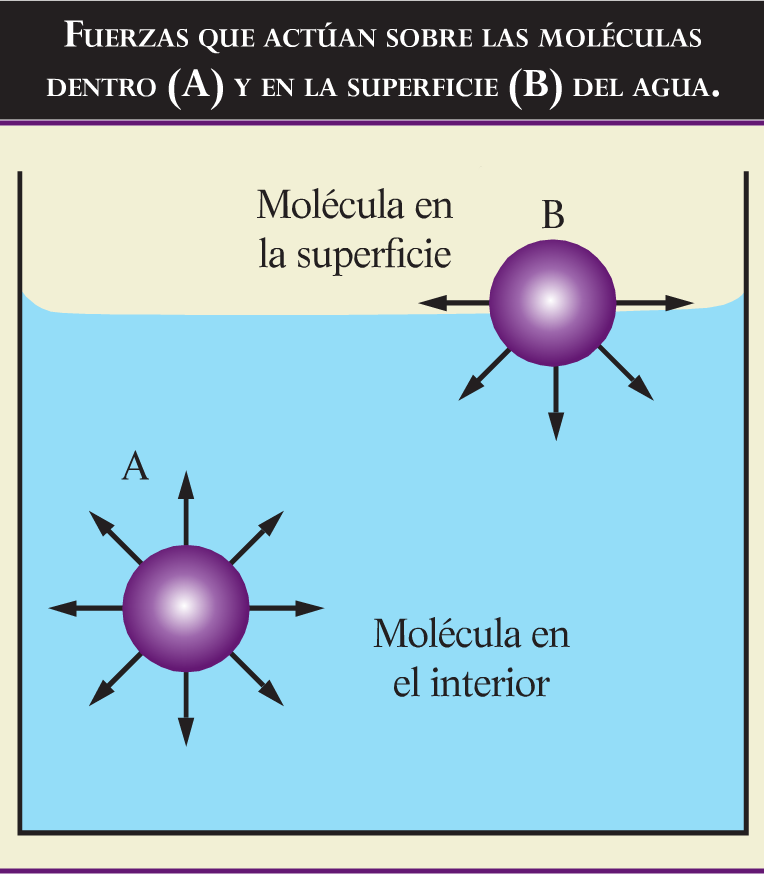
La tensión superficial
La polaridad es responsable de la tensión superficial que debe superar un producto para mezclarse con las moléculas de agua, que no es otra que la fuerza de la atracción que existe entre las propias moléculas de este disolvente. En la superficie las fuerzas intermoleculares tienden a impedir la penetración del producto en el liquido (figura).
Existen varias formas de romper la tensión superficial y facilitar la hidratación de las partículas:
- Uso de tensioactivos o humectantes, que facilitan la hidratación de las partículas (pueden encontrarse en los excipientes de los productos).
- Aumento de temperatura de la solución.
- Agitado (operación mas sencilla en cubos o tanques de predilucion que en grandes depósitos).
pH
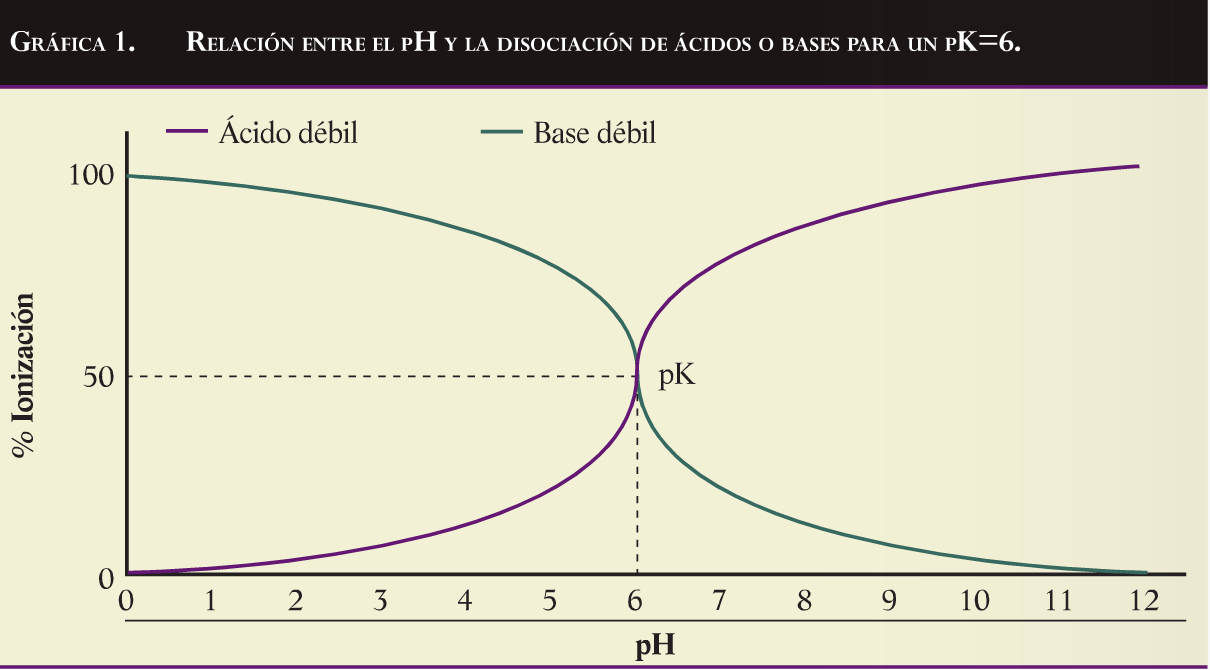
El pH de la solución interviene en la disociación de las sales en función del carácter acido o básico del principio activo (grafica 1). Asi, los acidos débiles ionizaran y, por tanto, solubilizaran mejor en soluciones básicas, mientras que las bases débiles lo harán en soluciones acidas. En la tabla se muestra el carácter acido o básico de principios activos utilizados habitualmente en agua:
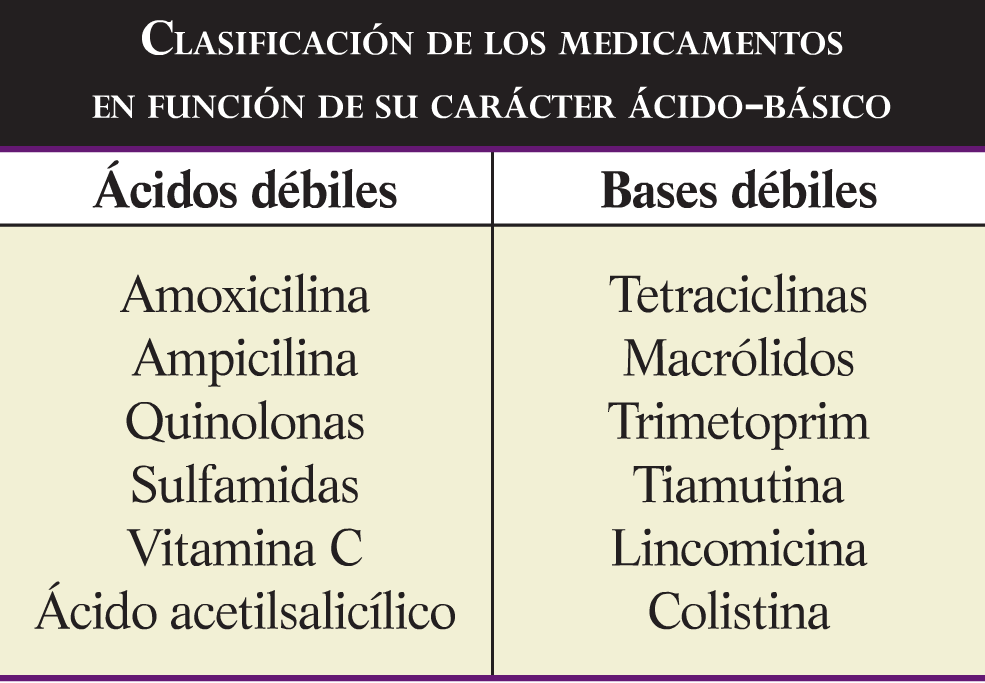
El pH no afecta igual a la ionización de las moléculas y esta muy relacionado con la constante de disociación (pK), que marca el equilibro entre la sal y las formas ionizadas de esta. Cuando el pK de la molecula el 50% estará en forma de sal y el otro 50% en forma ionica. Por encima del pK, en los acidos débiles, y por debajo del pK, en las bases débiles, el pH aumentara la solubilidad de las moléculas.
Según lo expuesto, deberemos tener en cuenta que:
- Variando el pH de la solución podemos mejorar la solubilidad, especialmente en sales con baja solubilidad. Algunos productos ya incorporan excipientes que adecuan el pH según el principio activo.
- Mezclar acidos débiles y bases débiles en una misma solución comprometerá su solubilidad.
- Si acidificamos el agua de forma habitual deberemos dejar de hacerlo temporalmente si esta acidificación puede comprometer la solubilidad o estabilidad del producto.
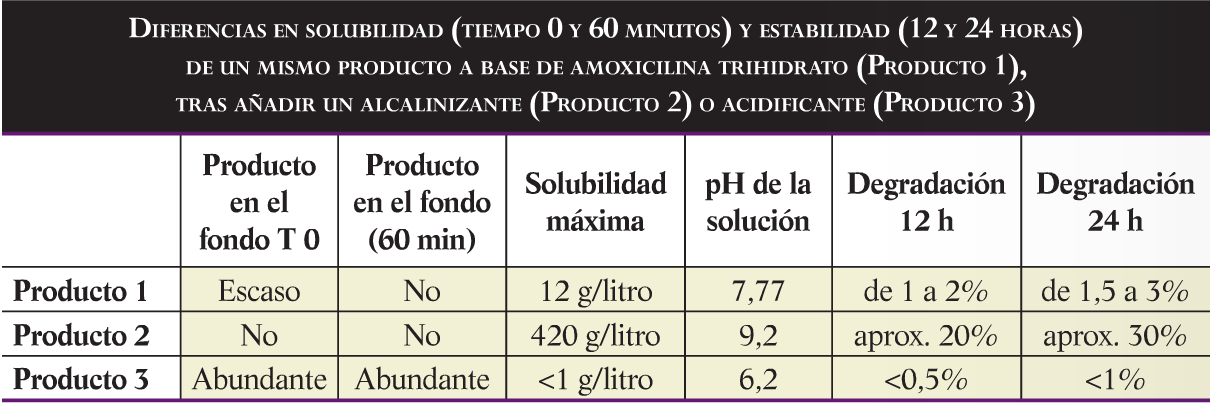
Sin embargo, también debemos tener en cuenta que el pH afecta a la degradacio de las moléculas, ya que cataliza las reacciones de hidrólisis. El problema es que en muchas ocasiones el pH optimo de solubilidad y estabilidad no coinciden. Asi, la amoxicilina, caracterizada por su baja solubilidad, aumenta su solubilidad en soluciones alcalinas pero también aumenta su velocidad de degradación. Como se ve en la tabla, el mismo producto a base de amoxicilina presenta una solubilidad y una degradación mayor al aumentar el pH de la solución.
La temperatura
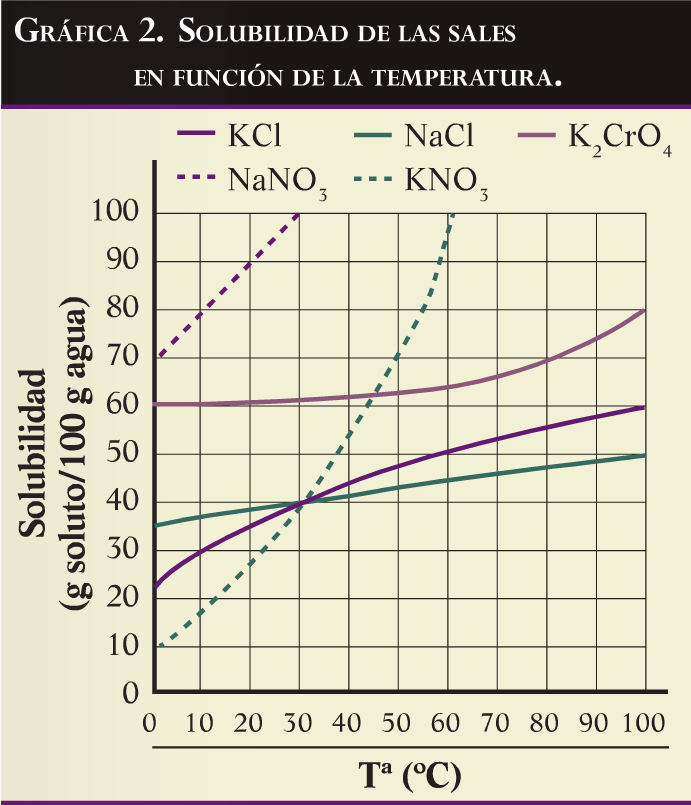
En general, el incremento de temperatura aumenta la solubilidad de las sales, aunque como puede verse en la grafica 2, no es asi para todos los compuestos. La temperatura hace variar las constantes de disociación y disminuye las fuerzas intermoleculares, lo que ayuda a superar la tensión superficial de los liquidos. Además, en general, los procesos de disolución son endotérmicos, por lo que se ven favorecidos por el aumento de temperatura.
Pero también deberemos tener en cuenta que la temperatura, en general, acelera los procesos degradativos de las moléculas, por lo que altas temperaturas favorecerán la degradación de los principios activos y reduciran su actividad. En invierno, con el agua a temperatura ambiente, disminuirá la solubilidad y la degradación del principio activo disuelto, mientras que en verano sucederá lo contrario.
Por tanto, siempre que sea posible haremos las predisoluciones con agua templada (20-40 ºC). Una vez hecha la predilucion será conveniente incorporarla al deposito o solución madre lo antes posible.
Dureza
La dureza del agua viene determinada principalmente por la concentración de sales minerales de calcio y magnesio (ya que son las que se encuentran en mayor cantidad) en una determinada cantidad de agua. Se expresa normalmente en equivalentes de carbonato de calcio (ppm de CO3Ca) y mas concretamente en grados hidrométricos, entre los que el grado francés (ºfH), equivalente a 10 ppm de CO3Ca es el mas habitual. El principal problema que presentan las aguas duras es que los iones Ca++ y Mg++ tienden a unirse a algunos principios activos ionizados (por ejemplo: amoxicilina, doxicilina) formando complejos insolubles que precipitaran, de manera que se reducirá la actividad del producto y se generaran obstrucciones en las cañerías y bebederos.
“Variando el pH de la solución podemos mejorar la solubilidad, especialmente en el caso de sales que la presentan baja.”
En la mayor parte del territorio español el agua es dura o muy dura, por lo que tendremos problemas de formación de complejos insolubles. Existen sistemas para reducir la dureza del agua mediante filtros, aunque suelen ser caros y raramente se aplican en explotaciones ganaderas.
En lo referente a la medicación en agua, puede ser interesante, si el producto utilizado no lo incorpora ya en el excipiente y el agua de que disponemos es muy dura, la utilización de productos con acción quelante (productos con gran afinidad por el Ca++ y el Mg++) como el acido cítrico. Debemos ser conscientes de que algunos productos se puede comprometer su solubilidad.
La oxidación y la fotolisis
La oxidación es el proceso de perdida de electrones que da lugar a compuestos deferentes al original, no activos, y que en ocasiones suponen un cambio en la coloración de la solución (doxiciclina). Generalmente las reacciones de oxidación se producen en presencia de oxigeno y vienen catalizadas por la luz, la temperatura y la presencia de metales pesados.
Los productos utilizados para la higienización del agua (cloro, peróxidos) se caracterizan por un alto poder oxidante, por lo que interaccionaran con los medicamentos. La luz, además de catalizar reacciones oxidativas, es responsable de la degradación de algunas moléculas mediante fotolisis. La interaccion de los fotones con las moléculas provoca la ruptura de los enlaces químicos.
Para evitar las reacciones de oxidación y fotolisis es recomendable:
- Proteger la solución de la exposición a la luz utilizando depósitos opacos.
- Evitar el contacto de la solución con metales pesados (hierro, cobre, etc.).
- Evitar temperaturas elevadas.
- Mantener cerrados los depósitos.
- Si es posible, no utilizar higienizantes a base de cloro o peróxidos durante la administración del medicamentos.
Descomposición enzimática
Las bacterias presentes en el agua o en el biofilm que recubre los conductos pueden aportar enzimas que descomponen los principios activos. La mejor forma de evitar estos procesos de descomposición es la higienización de depósitos, conductos y bombas de medicación de forma regular para evitar la formación de biofilm con productos capaces de arrastrarlo.
Para finalizar, es importante recordar que la mayor parte de los procesos de degradación que hemos visto afectan también a los productos en su envase original (alguno de ellos ya en disolución), por lo que es importante respetar las recomendaciones de conservación del fabricante.
Fuente: Revista Albéitar & Razas Porcinas.

La Selección Genética futura en hembras
Etiquetas: aguaaltasaméricaaminoanimalanimalesaumentobacteriasbajobasebásicobebederosCacantidadcríacriadorescrianzacursocursosespecialistasexplotacionesfármacoformadorguíaluzmanejomedicamentosmejorarmineralmineralesnutrienteolorPperdidapHPorcporcinaporcinasporcinoporcinospresencialpresiónproductoproductosrazarazasrazas porcinassistemasistemastemperaturatemperaturastérmicousausovelocidadveterinaria